
生命現象の根源にある化学反応のリアルに迫る
生命現象を階層分けして、紐解いていくと、代謝や成長、学習など高次の生体反応は、低次に位置する生体分子が起こす化学反応が連動・協奏・相互作用することによって起きています。そのため、高次の生体反応の究極的な理解は生体分子の反応機構の解明なくしては不可能である、と私は考えています。私は化学状態変化や構造変化といった生体分子のダイナミクスを『実時間で』観察し、反応中間体や遷移状態の化学情報および構造情報を明らかにする研究を展開しています。
生体分子の反応を化学的に解き明かす

これまで行われていた生命現象を理解するための実験の多くは、化学反応前と後の安定な状態を観測して比較するものでした。しかし生命現象を化学的に理解するためには、生体分子の安定な状態の観察だけでは不十分であり、遷移状態や反応中間状態といった不安定な過渡的状態の観察を行い、どのようなタイミングでどのような化学変化が起こっているのかを明らかにすることも必要です。
生体内の化学反応を担う主役はタンパク質です。これは3次元的な構造をダイナミックに変化させ、その過程で基質の分解や合成などに対する触媒作用あるいは情報伝達といった様々な機能を発現しています。これらの反応を中間状態で停止させることで過渡的状態を観察する手法は色々とあるのですが、反応を止めること自体が特殊な条件となってしまい、本当にその反応中間状態が意味のあるものなのかどうかの判別は困難です。また、遷移状態を実験的にトラップすることは不可能です。
タンパク質の構造ダイナミクスは、ピコ秒から秒、場合によっては時間のオーダーと幅広い時間領域に及びます。中でも機能や立体構造形成に関わる構造変化はマイクロ秒からミリ秒の時間にまたがっています。この短い時間で起こる変化を観察するため、マイクロメートルオーダーの流路を持つミキサーやフローセルといったマイクロ流路デバイスを独自に開発しました。これを用いて、従来観察することができなかったマイクロ秒の時間領域の実時間観察を可能にしたのです。
様々な反応状態を観察できるマイクロ流体デバイス
私が開発したマイクロ流路デバイスでは、別々の流路から流れてきた複数の液体がある部位で出会い、そこから分子拡散または乱流による流体混合によって溶媒条件が急激に変化します。例えば、変性剤によって立体構造を壊したタンパク質溶液と溶媒条件を生理条件に戻す緩衝溶液をマイクロ流路ミキサー中で反応させると、溶液が混合された場所(反応開始点)から立体構造の再形成が起こり、その反応が進行しながら観察流路を流れていくのです。この際に溶液が一定の速度で観察流路を流れるようにすると、反応開始点からの距離が反応時間と比例することになります。そのため、流路のどの場所で観察するかによって、反応過程の様々な段階を見ることができます。実際にX線小角散乱や赤外分光法によって観察したところ、初期段階でコンパクトな形に縮まった後に、αヘリックスやβシートといった二次構造がゆっくりと形成するという実験事実を得ることに成功しました。

図1. フォトリソグラフィとPDMSモールディングによって作製されたマイクロ流路ミキサー.(A)外観,(B)混合部分の拡大図
『生体分子システム』観察への挑戦
マイクロ流路デバイスと光を使った計測法は高い親和性を持っています。パルスレーザーを用いた蛍光寿命計測分光法を用いれば、アミノ酸間の距離や、その距離の分布の程度を知ることができ、硬い構造をしているのか、ふらふらと揺らいだ構造をしているのか、といった構造情報を得ることができます。また、赤外吸収や可視吸収分光法を用いると、反応に関連する官能基や活性中心、あるいは基質の化学状態を捉えることもできます。また、SPring-8やSACLAといった大型施設で提供されるX線光源を用いると、タンパク質の大きさや形状といった情報を得ることができます。これらの計測法を顕微化し、マイクロ流路デバイスと組み合わせることで、高時間分解能・試料消費抑制を実現し、これまで観ることのできなかったタンパク質の反応を観察することができるようになってきました。
この時間分解計測システムはマイクロ秒の時間領域において起こる反応、あるいは膜タンパク質に代表されるような低収量で試料調製が困難なタンパク質の反応の観察を可能にします。加えて、タンパク質-タンパク質間相互作用、あるいはタンパク質-基質間相互作用によって引き起こされる不可逆反応の解析へ応用することが可能です。したがって、分子生物学や生化学で解き明かされる分子機構に対して、化学的な理解へと深めていくための強力な手法となり得ると考えています。私自身はこのような強みを活かして、細胞膜間輸送を研究対象としながら、『膜タンパク質を含む複数の生体分子が、離合・集散を行いながら高度に制御された機能を発現する生体分子システムの分子機構解明』に挑戦しています。その研究をもとに、化学反応の共役・タンパク質間相互作用・構造変化の連動性、という分子システムの構築/作動原理を化学的に解き明かしたいと考えております。
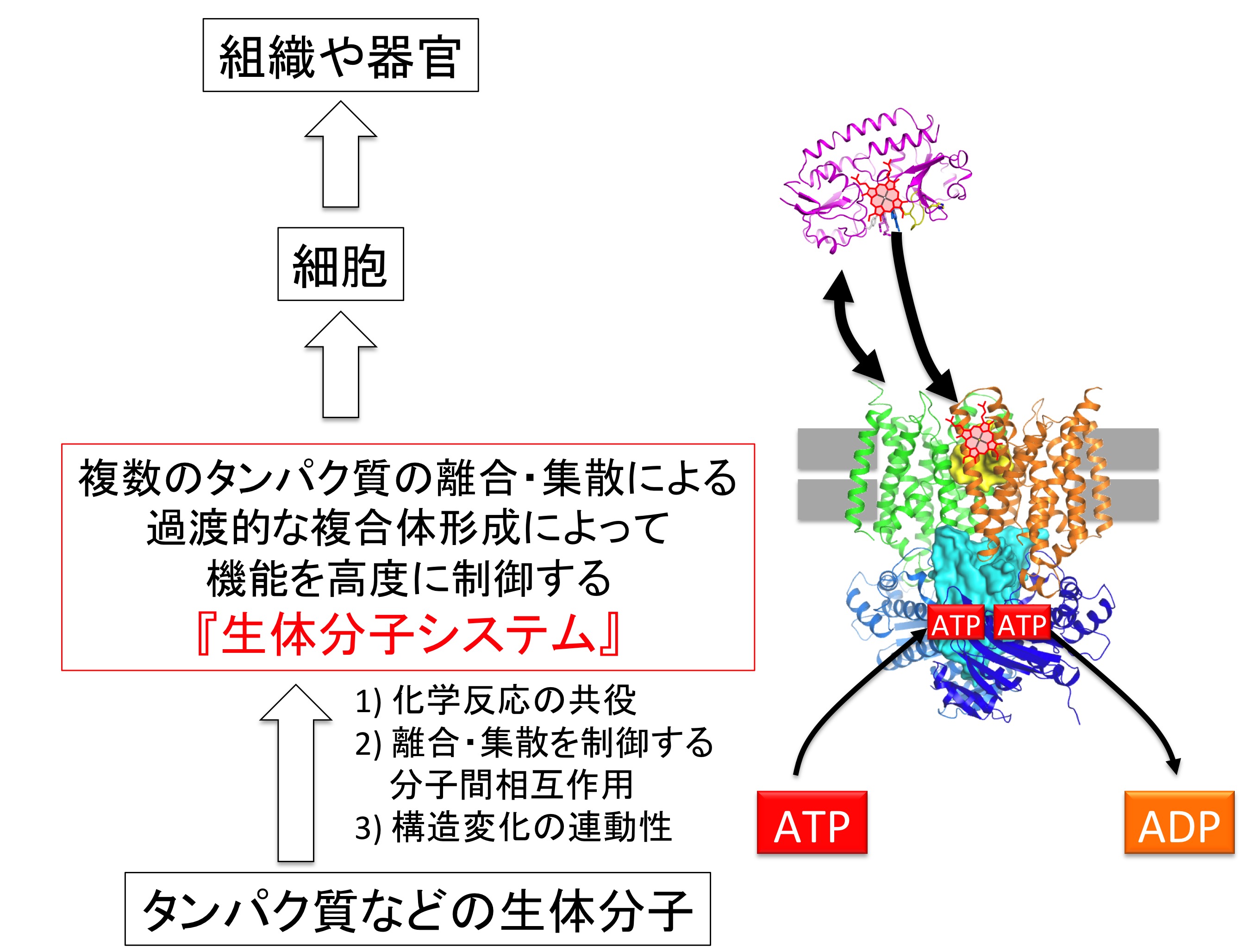
図2. 化学反応と共役して、タンパク質間相互作用、輸送基質の受け渡し、膜間輸送、構造変化が行われると考えられており、その化学的性質を知ることで、生体分子システムがどのような設計原理に基づいて構築されているかという知見を得ることができると期待される。
主要論文
- T. Kimura, et al. (2008) “Dehydration of mainchain amides in the final folding step of single chain monellin revealed by time-resolved infrared spectroscopy”, Proc. Natl. Acad. Sci. USA, 105(36), 13391-13396.
- T. Kimura, J. C. Lee, H. B. Gray, J. R. Winkler (2009) “Folding energy landscape of cytochrome cb562”, Proc. Natl. Acad. Sci. USA, 106(19), 7834-7839
- Y. Furutani, T. Kimura, K. Okamoto (2013) “Development of a rapid buffer-exchange system for time-resolved ATR-FTIR spectroscopy with the step-scan mode”, Biophysics, 9, 123-129
